지난 13일 미FDA 국장은 유전자 치료제 개발에 관한 가이드라인을 발표했으며 국내 유전자 치료 업체들에게 날개를 달아줄 것으로 전망된다.
가이드라인에는 특정 질병에 초점을 맞춘 유전자 치료제 개발 지침 초안 3건과 유전자 치료제 제조에 관한 생산 및 장기투여 안전성 등의 기존 3건의 지침 업데이트가 포함됐다.
유전자치료제의 경우 화학 치료제의 역사에 비한다면 사실상 매우 짧은 역사를 지녀 가이드라인이 없었다. 그에 따라 유전자치료제를 연구하는 기업들의 임상이 미FDA의 가이드라인 부재로 본의 아니게 지연 되는 일이 잦았다.
그렇기 때문에 이번 미FDA의 가이드라인 발표는 국내 유전자치료제 개발 기업들에게 임상의 가속화 발판이 마련된 것으로 평가된다.
특히나 희귀질환 신약개발 파이프라인에 주목해야 한다.
유전자 치료제는 대부분 선천성 유전자 질환과 같은 높은 미충족수요가 있는 질환을 대상으로 연구되고 있으며 미국립보건원에 따르면 희귀질환의 약 80%는 단일유전자 결함으로 발생하는 것으로 알려져 있다.
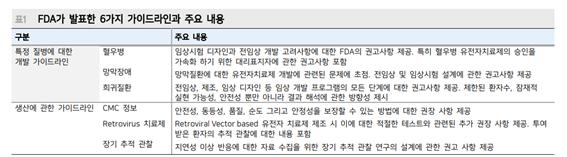
미FDA는 이번 업데이트에서 유전자 치료제 임상 시험 진행승인을 위한 제조, 품질관리, 추적관찰, 레트로바이러스 벡터 기반 유전자 치료제 테스트 등의 기존 지침을 업데이트했다.
벡터란 유전자 물질을 전달하는 운반체를 의미하며 레트로바이러스는 RNA 형태로 유전자 물질을 전달하는 벡터 중 하나로 DNA에 결합이 가능하며 발현시간이 짧고 안정성이 좋은 것으로 알려져 있다.
이미 미FDA는 ‘2016년 말 21세기 치료법 제정‘을 통해 다양한 신속 심사 프로그램을 운영하고 있다.
주요 프로그램은 총 5가지로 Fast Track, Breakthrough Therapy, RMAT(Regenerative Medicine Advanced Therapy), Accelerated Approval, Priority Review 이 여기에 해당된다.
이 프로그램들은 미 충족 의료수요가 높은 약물의 개발 과정을 효율화하기 위해 만들어졌다.
모두 중증 질병상태 치료제를 지정 요건으로 지정하고 있으며 임상 초기 단계에서 기존 치료법 대비 유의미한 개선을 보였거나 미충족 의료 수요를 해결할 수 있음을 입증할 수 있을 경우 신속 심사 프로그램으로 지정되어 다른 치료제들보다 빠르게 심사를 받고 보다 집약적인 가이던스를 미FDA로부터 받을 수 있다.
국내에서는 바이로메드가 현재 이 레트로바이러스에 대한 연구 성과를 가지고 있는 것으로 알려져 있으며 주요 치료제 중 하나인 당뇨병성 신경병증 치료제는 미FDA의 RMAT승인을 받은 21개의 약물 중 하나로 임상 3상을 진행 중이다.
미FDA의 기준에 따라 바이로메드처럼 현재 시장에 치료제가 없는, 미충족 수요가 매우 높은 치료제를 연구하는 기업들을 먼저 바라볼 필요가 있다.
특히 임상 2상을 신청하기 전 단계가 신속심사 프로그램을 신청하기에 가장 이상적이라고 미FDA가 밝히고 있기 때문에 현재 임상 1상을 진행하는 치료제들 중 시장에 아직까지 치료제가 없다고 평가되고 있는, First in Class 약물이라고 알려진 치료제들을 우리는 주목할 필요가 있겠다.
이경훈 기자 news@thebigdata.co.kr
<저작권자 © 빅데이터뉴스, 무단 전재 및 재배포 금지>